Quanto è una mole?
Sommario
- Quanto è una mole?
- Come si misura la quantità di sostanza?
- Come si calcola la massa molare esempi?
- Qual è lo strumento per misurare la quantità di materia?
- Come si calcola la massa relativa?
- How to calculate the molecular formula?
- How do you calculate moles?
- How do you calculate mole in chemistry?
- How does one determine a molecular formula from the empirical formula?
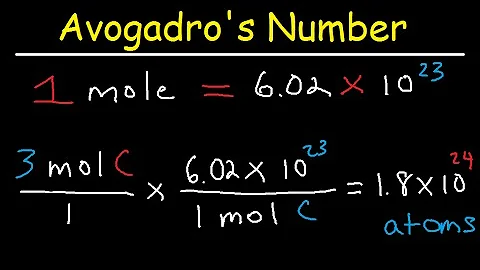
Quanto è una mole?
La massa molare del sodio è 22,99 g/molNa. Analogamente, nel caso dell'acqua (H2O), la massa molecolare è pari a 18,016 u; una mole di questa sostanza è pari a 18,016 grammi.
Come si misura la quantità di sostanza?
MOLE = quantità di sostanza pura che contiene il 6. particelle elementari (atomi, molecole, ioni o altre unità microscopiche. Per calcolare la massa di una mole di atomi di una certa sostanza, si moltiplica la massa di un atomo per la costante di Avogadro.
Come si calcola la massa molare esempi?
Moltiplica la massa atomica di ogni elemento per il numero di atomi coinvolti. In questo modo trovi la quantità di ciascun elemento all'interno del composto. Per il cloruro d'idrogeno, HCl, la massa molare di ciascun elemento è pari a 1,007 g/mol per l'idrogeno e 35,453 g/mol per il cloro.
Qual è lo strumento per misurare la quantità di materia?
mòle (unità di misura)
Come si calcola la massa relativa?
La massa atomica relativa di un atomo (simbolo: PA) è determinata per confronto con l'unità di massa atomica; viene infatti calcolata dal rapporto tra la massa assoluta in kg dell'atomo e la massa di un uma (= 1,66·10-27 kg).
How to calculate the molecular formula?
- Multiply all the elemental atomic weights with their respective suffixes that are present in the empirical formula,and add all these values to get the empirical formula weight/empirical ...
- Note down the molecular weight of the compound,and divide it by the empirical unit weight (M w ). This will give you the number of empirical units.
- If the weight of the compound is only given in grams,then the number of moles need to be found out (for gaseous compounds).
- The number of empirical units correspond to the molecular units. ...
How do you calculate moles?
- Find the Number of Moles of Each Element. The molar mass of hydrogen is 1 g (rounding to one decimal place),so the number of moles present in the compound ...
- Divide the Lowest Number Into the Others. Calcium is the element with the lowest number of moles,which is 0.337. ...
- Write the Empirical Formula. ...
How do you calculate mole in chemistry?
- You calculate the number of moles by dividing the mass of substance by the substance’s atomic or molecular weight. You then find the mole fraction by dividing the moles of one substance in a mixture by the total number of moles of all substances in the mixture.
How does one determine a molecular formula from the empirical formula?
- Divide this number by the molecular weight of the empirical formula to find the number of empirical formula units that make up the compound. Number of empirical formula units in compound = 180.18 g/mol/30.03 g/mol.















