Cosa sono gli isotopi di idrogeno?
Sommario
- Cosa sono gli isotopi di idrogeno?
- Quando si dice isotopo?
- Perché sono importanti gli isotopi?
- Come si formano gli isotopi degli atomi?
- Dove si trova l'idrogeno in natura?
- Quali sono gli isotopi radioattivi?
- Cosa cambia negli isotopi?
- Quali sono gli isotopi stabili più studiati?
- Come calcolare il rapporto isotopico tra due isotopi?
- Quali sono gli isotopi di un elemento chimico?
- Quali sono i tre isotopi dell'idrogeno?
Cosa sono gli isotopi di idrogeno?
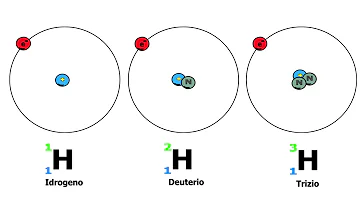
In natura esistono 3 isotopi dell'idrogeno (H): 1H (prozio), 2H (deuterio) e 3H (trizio), mentre gli altri (da 4H a 7H) hanno un nucleo fortemente instabile che impedisce un'emivita superiore anche solo al millesimo di secondo.
Quando si dice isotopo?
Atomi che hanno lo stesso numero atomico Z (e quindi appartengono allo stesso elemento), ma differiscono per il numero di massa A prendono il nome di isotopi.
Perché sono importanti gli isotopi?
Le misurazioni dei rapporti di un isotopo stabile presente naturalmente rispetto ad un altro giocano un importante ruolo nella datazione radiometrica e nella geochimica isotopica, e sono utili anche per determinare i modelli delle precipitazioni piovose e i movimenti degli elementi attraverso gli organismi viventi, ...
Come si formano gli isotopi degli atomi?
Per gli atomi di uno stesso elemento, resta fisso il numero dei protoni, ma può variare quello dei neutroni: sono detti isotopi gli atomi di uno stesso elemento aventi lo stesso numero atomico, ma diverso numero di massa, poiché diverso è il numero dei neutroni presenti nel nucleo.
Dove si trova l'idrogeno in natura?
Sulla Terra è presente ampiamente nell'acqua, nei composti organici e negli esseri viventi, mentre nelle stelle lo troviamo allo stato gassoso. L'idrogeno è un combustibile poco inquinante e con un grande potere calorifico che lo rende particolarmente efficiente.
Quali sono gli isotopi radioattivi?
I radioisotopi sono isotopi radioattivi, cioè radionuclidi di uno stesso elemento chimico. Il termine più corretto per indicare una specie atomica con un nucleo formato da un determinato numero di protoni Z (numero atomico) e un determinato numero di neutroni N è infatti nuclide o, se radioattivo, radionuclide.
Cosa cambia negli isotopi?
Gli isotopi di uno stesso elemento, quindi, pur condividendo lo stesso numero di protoni ed elettroni, differiscono tra loro per il numero di neutroni contenuti all'interno del nucleo.
Quali sono gli isotopi stabili più studiati?
- Tra gli isotopi stabili più studiati ci sono: l'idrogeno, il boro, il carbonio, l'azoto, l'ossigeno e lo zolfo, chiamati anche isotopi leggeri.Di solito gli isotopi dello stesso elemento sono presenti in natura in diverse concentrazioni: uno in alta concentrazione e l'altro, normalmente, in tracce.
Come calcolare il rapporto isotopico tra due isotopi?
- Il rapporto isotopico tra due isotopi viene calcolato mettendo l'isotopo pesante al numeratore (es. R = D/H o 18 O/ 16 O).
Quali sono gli isotopi di un elemento chimico?
- Gli isotopi di un elemento chimico, infatti, hanno lo stesso numero atomico Z e quindi occupano lo stesso posto nella tavola periodica. Inoltre, pur avendo masse differenti, non differiscono nel loro comportamento chimico, perchè hanno lo stesso numero di protoni e quindi lo stesso numero di elettroni.
Quali sono i tre isotopi dell'idrogeno?
- I tre isotopi dell'idrogeno hanno un protone ciascuno ma differiscono per il numero di neutroni. Il prozio non ha neutroni, il deuterio ne ha uno e il trizio ne ha due. Ciascun elemento è costituito da una miscela di isotopi in percentuale sempre costante.















