Cosa succede tra acido e base?
Sommario
- Cosa succede tra acido e base?
- Come bilanciare una reazione acido-base?
- Come scrivere una reazione acido-base?
- Come prevedere la direzione di una reazione acido-base?
- A cosa è dovuto il comportamento acido di una sostanza?
- Cosa vuol dire neutralizzare l'acido?
- Come si fa a bilanciare una reazione?
- Come si bilanciano le reazioni di neutralizzazione?
- Quale l'acido più potente al mondo?
- Come riconoscere l'acido più forte?
- Quali sono le reazioni acido-base?
- Qual è la differenza tra reazioni acido-base e ossido-riduzione?
- Come si trasforma l'acido in base?
- Qual è la costante di equilibrio degli acidi?
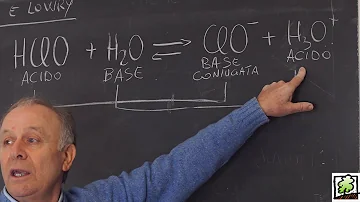
Cosa succede tra acido e base?
Le reazioni tra un acido e una base si chiamano reazioni di neutralizzazione e portano alla formazione di un sale e di acqua (la neutralizzazione avviene di fatto tra gli ioni H+ e OH- che reagiscono tra loro formando acqua).
Come bilanciare una reazione acido-base?
0:437:56Clip suggerito · 53 secondiBilanciamento delle reazioni acido base. Esempio 1. - YouTubeYouTubeInizio del clip suggeritoFine del clip suggerito
Come scrivere una reazione acido-base?
Un esempio di reazione acido-base è quella che avviene tra bicarbonato di sodio e acido acetico, con produzione di acetato di sodio: CH3COOH + NaHCO3 → CH3COONa + H2O + CO.
Come prevedere la direzione di una reazione acido-base?
Tenendo presente che per una coppia acido-base coniugata vale la relazione Ka×Kb = Kw, per stabilire la direzione dell'equilibrio basta quindi confrontare la forza dell'acido acetico (Ka = 1,8×10-5) con quella dell'acqua (Ka = 1,8×10-16).
A cosa è dovuto il comportamento acido di una sostanza?
Secondo la teoria di Arrhenius, un acido è una sostanza che dissociandosi in acqua libera ioni H+. Una base è invece una sostanza che dissociandosi in acqua libera ioni OH-. ... La "forza" di un acido, e con essa anche i suoi effetti corrosivi e irritanti, è misurata per il tramite della costante di dissociazione acida.
Cosa vuol dire neutralizzare l'acido?
Per neutralizzazione si intende l'avanzamento di una reazione acido-base fino al suo punto di equivalenza, ovvero la condizione per cui il reagente acido ed il reagente basico si trovano in soluzione in quantità tali da liberare lo stesso numero di equivalenti (rispettivamente ioni H+ e ioni OH−) che danno luogo alla ...
Come si fa a bilanciare una reazione?
Per bilanciare una reazione, le formule chimiche di reagenti e prodotti devono essere moltiplicate per i fattori numerici che consentono di far comparire a destra e sinistra dell'equazione lo stesso numero di atomi.
Come si bilanciano le reazioni di neutralizzazione?
Bilanciare l'equazione chimica L'equazione di neutralizzazione di HCl + NaOH ti dà H2O + NaCl è già bilanciata perché ci sono due moli di H su entrambi i lati, una mole di Cl su entrambi i lati, una mole di Na su entrambi i lati e una mole di O su entrambi i lati .
Quale l'acido più potente al mondo?
Acido fluoroantimonico L'acido fluoroantimonico HSbF6 è una miscela di acido fluoridrico e pentafluoruro di antimonio in diverse proporzioni. La miscela con rapporto 1:1 costituisce il più forte superacido.
Come riconoscere l'acido più forte?
quando la differenza tra atomi di idrogeno e ossigeno è MAGGIORE o uguale a 2, l'acido in questione è FORTE; se invece è MINORE di 2, l'acido è DEBOLE. In H2SO3 la differenza tra H e O è 1 quindi l'acido è debole; in H2SO4 la differenza è 2, quindi l'acido è forte.
Quali sono le reazioni acido-base?
- Altri esempi di reazioni acido-base sono: #1. H 3 O + + NH 3 → NH 4 + + H 2 O . Ad esempio HCl + NH 3 → NH 4 Cl #2. H 3 O + + N 2 H 4 → N 2 H 5 + + H 2 O . Ad esempio HCl + N 2 H 4 → N 2 H 5 Cl #3. H 3 O + + PH 3 → PH 4 + + H 2 O . Ad esempio HCl + PH 3 → PH 4 Cl
Qual è la differenza tra reazioni acido-base e ossido-riduzione?
- Un esempio di reazione acido-base è quella che avviene tra bicarbonato di sodio e acido acetico, con produzione di acetato di sodio: CH 3 COOH + NaHCO 3 → CH 3 COONa + H 2 O + CO 2 Differenza (convenzionale) tra reazioni acido-base e reazioni di ossido-riduzione ...
Come si trasforma l'acido in base?
- In tale reazione l'acido si trasforma nella propria base coniugata. Pertanto viene introdotto il concetto di complementarità tra acido e base, dato che l'acido non è tale se non in presenza di una controparte cui donare il proprio ione H +, e la base non è tale se non in presenza di una controparte da cui accettare uno ione H +.
Qual è la costante di equilibrio degli acidi?
- La costante di equilibrio, e quindi il pK a, ci permette di valutare la forza degli acidi Un acido è tanto più forte quanto più è dissociato, cioè quanto più l'equilibrio è spostato verso destra. Più forte è un acido, più grande è il valore della sua costante di equilibrio termodinamica K a, più piccolo è il numero del suo pK a















